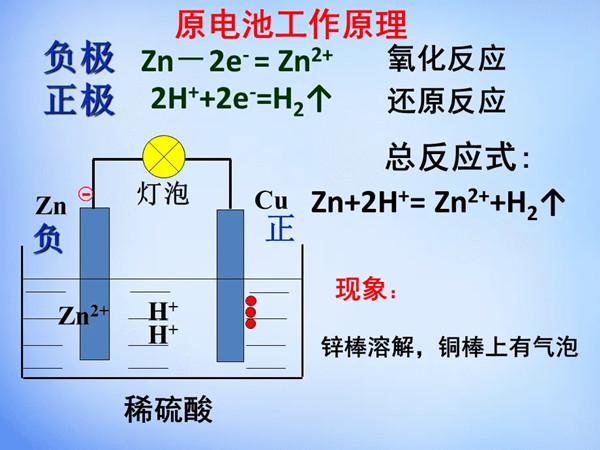
原电池工作原理是怎么样的?
原电池是通过氧化还原反应而产生电流的装置称为原电池,也可以说是将化学能转变成电能的装置。有的原电池可以构成可逆电池,有的原电池则不属于可逆电池。原电池放电时,负极发生氧化反应,正极发生还原反应。例如铜锌原电池又称丹尼尔电池,其正极是铜极,浸在硫酸铜溶液中;负极是锌板,浸在硫酸锌溶液中。两种电解质溶液用盐桥连接,两极用导线相连就组成原电池。平时使用的干电池,是根据原电池原理制成的,既然如此,那原电池工作原理是怎么样的呢?
一、原电池工作原理
原电池反应属于放热的反应,一般是氧化还原反应,但区别于一般的氧化还原反应的是,电子转移不是通过氧化剂和还原剂之间的有效碰撞完成的,而是还原剂在负极上失电子发生氧化反应,电子通过外电路输送到正极上,氧化剂在正极上得电子发生还原反应,从而完成还原剂和氧化剂之间电子的转移。两极之间溶液中离子的定向移动和外部导线中电子的定向移动构成了闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流,实现化学能向电能的转化。
但是,需要注意,非氧化还原反应一样可以设计成原电池。从能量转化角度看,原电池是将化学能转化为电能的装置;从化学反应角度看,原电池的原理是氧化还原反应中的还原剂失去的电子经外接导线传递给氧化剂,使氧化还原反应分别在两个电极上进行。
二、原电池形成条件原理
1、电极数据由两种不同生动性的金属或其他导电材料(非金属或某些氧化物等)组成。
2、电解质的存在。
3、电线连接在两个电极之间形成一个闭合电路。
4、发生的反应是自发的氧化还原反应。
只要前三个条件可以构成原电池。由于化学电源要供应持续稳定的电流,所以要有原电池的三种成分,但也要自发的化学反应。也就是说,化学电源是原电池所必需的,但原电池不一定能制造化学电池。
组成前提:总反应是自发的化学反应。
注:新课化学中所有的原电池都有氧化还原反应,但非氧化还原反应可以规划成原电池。
三、原电池常见电极
1、活泼性不同的金属:如锌铜原电池,锌作负极,铜作正极;
2、金属和非金属(非金属必须能导电):如锌锰干电池,锌作负极,石墨作正极;
3、金属与化合物如:铅蓄电池,铅板作负极,二氧化铅作正极;
4、惰性电极如:氢氧燃料电池,电极均为铂。
四、原电池正负极如何判断
负极:电子流出的一极(负极定义);化合价升高的一极;发生氧化反应的一极;活泼性相对较强(有时候也要考虑到电解质溶液对两极的影响)金属的一极。(仅适用于原电池)
正极:电子流入的一极(正极定义);化合价降低的一极;发生还原反应的一极;相对不活泼(有时候也要考虑到电解质溶液对两极的影响)的金属或其它导体的一极。(仅适用于原电池)
阳极:发生氧化反应的电极(阳极定义)
阴极:发生还原反应的电极(阴极定义)
在原电池中,外电路为电子导电,电解质溶液中为离子导电。
相关文章
-

无人机电池循环次数查询 锂电池循环次数怎么算
2025-03-12 -

如何根据需求选择最佳电池组:容量、性能及其他关键要素
2025-03-07 -

2025 国内锂电池厂家排行榜:探寻技术实力的巅峰
2025-03-05